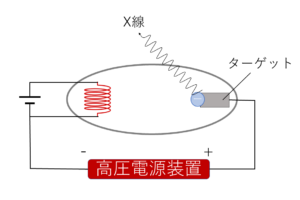
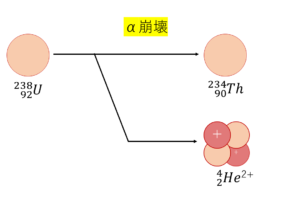
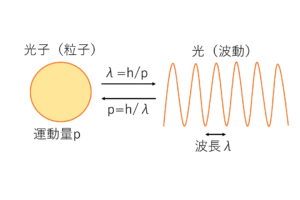
こんにちは.今回は,物理の世界の原子核のお話.
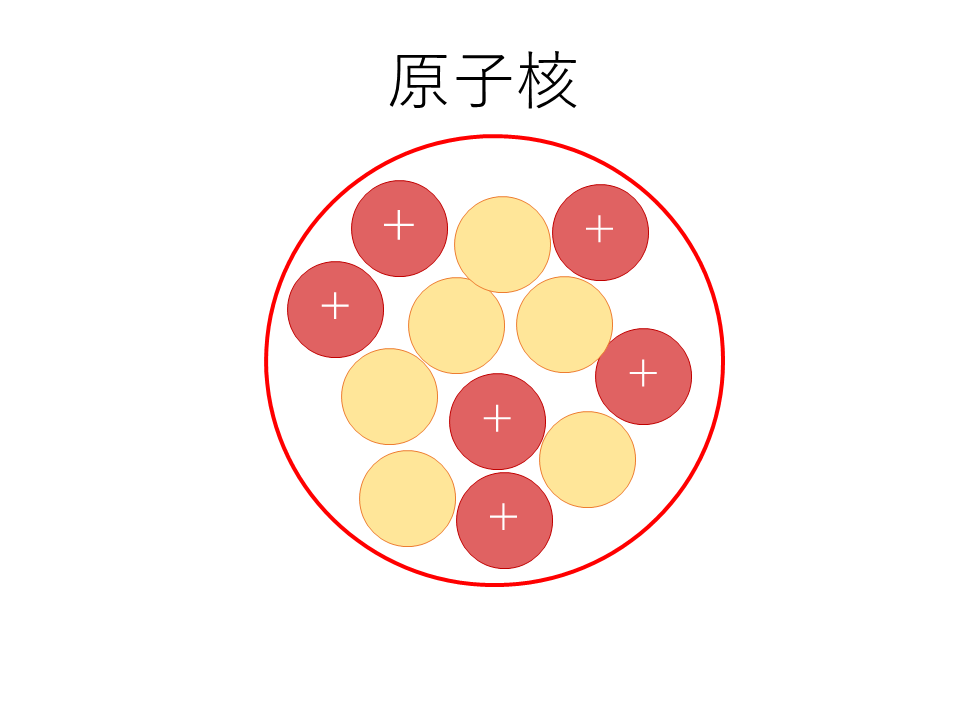
原子核
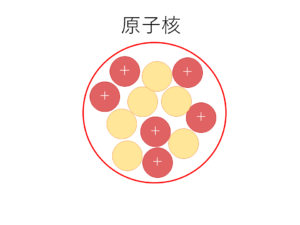
さすがに原子核は化学で勉強したので知ってますよね????
チョーざっくり言うと,原子よりも相当小さい大きさで,正の電荷を持つ陽子と電荷を持たない中性子が密集したものです.
あと用語として,陽子も中性子もひっくるめて,原子核の中にある粒子のことを「核子」と呼びます.
下の表に電子や核子の電荷や質量をまとめてみました.
| 粒子の名称 | 電気量[C] | 質量[kg] | ||
| 原子 | 原子核 | 陽子 | \(+e\) | \(1.673 \times 10^-27\) |
| 中性子 | 0 | \(1.675 \times 10^-27\) | ||
| 電子 | \(-e\) | \(9.109 \times 10^-31\) |
この表から抑えることは3つです.
- 陽子と電子の電荷は逆符号で大きさは等しい
- 中性子と陽子の質量はほぼ一緒
- 電子はクッソ軽い
こんなもんです.
一般に,陽子や中性子,電子の数は,それを表すアルファベットが決まっています.
| 名称 | 別名 | アルファベット |
| 原子番号 | 陽子の数 | \(Z\) |
| 中性子の数 | \(N\) | |
| 質量数 | 中性子数+陽子数 | \(A\)または\(Z+N\) |
| 電子の数 | 陽子と同じ |
陽子の数\(Z\),陽子の持つ電荷は\(+e\)なので,原子核の持つ電荷は,
$$+Ze$$
となります.
陽子密集したら静電気力で反発しない?!
通常同じ符号の電荷を持つ粒子が集まると,クーロン力によって反発しようとする力を受けます.
しかし,原子核内では核子同士が静電気力よりもずっと強力な「核力」というものが働いて,核子同士を結びついています.
原子番号と質量数表記の決まり(復習)
これはがっつり化学の復習になるので,わかっている人は読み飛ばしてください.
$$^{12}_6 C$$
元素記号の左上に相対質量,左下に原子番号が来ます.
原子番号と元素記号は一対一で結びついているので,原子番号についてはしょっちゅう省略されます.
ただ,これからα崩壊,β崩壊を勉強していくので,元素記号の左上に書いているものが質量数なのはしっかりと覚えておきましょう!これからの鉄則になりますよ~
同位体と統一原子質量単位・原子量
電子の数と陽子の数は原子によって決まっていますが,中性子の数は必ずしも電子や陽子と同じとは限りません.
電子や陽子の数が同じで,中性子の数だけ違う原子同士を「同位体」と呼びます.
同位体です,間違っても同素体とは書かないでください!結構パニくるとミスります.
同位体の関係は↓のような状態.
$${}^{12}_6 C {}^{13}_6 C$$
左側は中性子が6個,右側は中性子が7個ですが,両方とも電子や陽子は6個なのは見てわかる通り.中性子の数が違いますよね??これが同位体の状態.
※イオンになってしまうと電子がどっか行ったりどっかからやってきたりして陽子の数と電子の数が狂ってしまいます.この話はイオンになっていない状態を前提に話しています.
原子一つあたりの質量って想像したらわかると思うんですけどとにかく小さいんですよね.
いちいち10のマイナス何乗とかって表記していては手間ですしわかりにくくてミスも増えます.
ということで,\(^{12}_6C\)を12等分した質量を基準とした単位が誕生しました.
この単位のことを「統一原子質量単位」と呼びます. 記号は[u].
さらに,12uを基準として,\(^{12}_6 C\)が持っている質量を12とした時,他の原子は相対的にどれくらいの質量をもっているかというのを示す値を「原子量」と呼びます.
もちろん各元素の中でも同位体が存在するので,ある元素の原子量を求めたいときは,同位体をひっくるめて平均原子量で表されます.
例) \(^{35}_{17} Cl\)と\(^{37}_{17} Cl\)は3:1の比率で自然界に存在する.塩素Clの原子量を求めよ.


コメントを残す